去分化脂肪肉瘤首个口服非化疗药!首创核输出抑制剂Xpovio 3期疗效显著,德琪医药引入中国!

2020年11月22日讯 /生物谷BIOON/ --德琪医药合作伙伴Karyopharm Therapeutics近日在结缔组织肿瘤学学会2020年年会(CTOS 2020)上公布随机、双盲、安慰剂对照、交叉SEAL研究3期部分的阳性顶线结果。该研究在既往接受过至少2种疗法的晚期不可切除性去分化脂肪肉瘤患者中开展,评估了Xpovio(selinexor)作为单药疗法相比安慰剂的疗效和安全性。结果显示,研究达到了主要终点,与安慰剂相比,Xpovio显著延长了无进展生存期(PFS)。
SEAL研究结果标志着Xpovio在实体瘤中的首次阳性后期临床数据,突出了该药在其他实体瘤适应症中未来潜力方面的重大进展。基于该研究结果,Karyopharm计划在2021年第一季度向美国FDA提交一份新药申请(NDA),寻求批准Xpovio治疗去分化脂肪肉瘤患者。如果获批,Xpovio将成为治疗去分化脂肪肉瘤的第一个口服非化疗药物。来自SEAL研究令人鼓舞的数据也为推进Xpovio在其他实体肿瘤适应症中的临床开发提供了额外的理论依据,包括子宫内膜癌、胶质母细胞瘤、肺癌和目前正在进行临床研究的其他癌症。
CTOS 2020年会上公布的具体数据显示:Xpovio组的中位PFS为2.83个月、安慰剂组为2.07个月(HR=0.70;p=0.023)。这些数据表明,与安慰剂相比,Xpovio治疗将疾病进展或死亡风险降低了30%。估计的6个月病情无进展(PFS)生存率,Xpovio组为23.9%、安慰剂组为13.9%;估计的12个月PFS生存率,Xpovio组为8.4%、安慰剂组为2%。Xpovio组有7.5%的患者疾病负担(以靶病变大小来衡量)减轻了≥15%,安慰剂组没有患者达到这一水平。
该研究允许服用安慰剂且病情客观进展的患者转入Xpovio治疗组。与那些从研究开始进入安慰剂组并且从未转入Xpovio治疗组的患者相比,接受Xpovio治疗的患者中,中位总生存期(OS)有改善的趋势:接受Xpovio治疗的患者,中位总生存期(OS)为9.99个月,而从未接受过Xpovio治疗的患者中位OS为9.07个月(HR=0.69;p=0.122)。
该研究中,Xpovio的安全性与先前的临床研究一致,与治疗多发性骨髓瘤和弥漫性大B细胞淋巴瘤(DLBCL)患者的临床研究相比,血液学和感染性不良事件较少。研究中,最常见的与治疗相关的不良事件(AE)是血细胞减少和胃肠道和体质症状。大多数不良事件可以通过剂量调整和/或标准支持性护理来控制。最常见的非血液学治疗相关不良事件为恶心(81%)、食欲下降(60%)、疲劳(51%)和呕吐(49%),主要为1级和2级事件。最常见的3级和4级治疗相关不良事件为贫血(19%)、低钠血症(11%)、血小板减少症(10%)和乏力症(10%)。
SEAL研究的首席调查员、斯隆凯特灵癌症中心肉瘤服务和开发治疗服务中心主治医师Mrinal M. Gounder表示:“去分化脂肪肉瘤是一种特别具有侵袭性的肿瘤,发生于人体脂肪组织,通常与高转移复发率和死亡率相关。不幸的是,对于晚期疾病患者几乎没有有效的治疗选择。CTOS 2020年会上展示的数据表明,与安慰剂组相比,接受Xpovio治疗的患者中位无进展生存期(PFS)在统计学上有显著改善。对这些患者来说,延长PFS是一个重要的临床目标,因为这种疾病的迅速发展往往转化为早期死亡。”
Karyopharm总裁兼首席科学官Sharon Shacham博士表示:“我们很高兴与大家分享SEAL研究3期部分的重要结果,这是Xpovio在实体肿瘤适应症方面的第一个、晚期临床数据。我们相信这些数据有力地支持了我们的目标,即开发每周2次的Xpovio,作为一种有效、方便、新颖的口服疗法,延长晚期不可切除去分化脂肪肉瘤患者的无进展生存期(PFS)。我们对这些数据感到特别兴奋,因为Xpovio是第一个在先前治疗过的脂肪肉瘤患者中显示出活性的口服疗法。我们期待着在2021年第一季度向美国食品和药物管理局(FDA)提交一份新药申请(NDA),寻求批准Xpovio对SEAL研究的患者群体进行治疗。如果获得批准,Xpovio将成为用于治疗去分化脂肪肉瘤患者的第一个口服非化疗药物。”
Xpovio是一款首创(first-in-class)、选择性核输出抑制剂(SINE)。2018年8月,德琪医药与Karyopharm Therapeutics达成战略合作,共同开发4款口服创新药物,包括3款SINE XPO1拮抗剂Xpovio(selinexor)、eltanexor、verdinexor和一款PAK4和NAMPT双靶点抑制剂KPT-9274。2019年1月,ATG-010(Xpovio)治疗难治复发多发性骨髓瘤在中国获批临床批件,该药也是中国市场开发用于多发性骨髓瘤的首个选择性核输出抑制剂(SINE)。
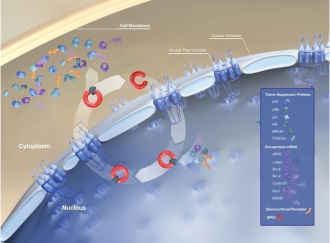
Xpovio的活性药物成分为selinexor,这是一种首创、口服、选择性核输出抑制剂(SINE)化合物,通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响。
在美国,Xpovio已被FDA批准2个肿瘤适应症,用于治疗五重难治性多发性骨髓瘤(MM)和复发或难治性弥漫性大B细胞淋巴瘤(DLBCL),具体为:(1)联合地塞米松,用于既往接受过至少4种疗法且对至少2种蛋白酶体抑制剂(PI)、至少2种免疫抑制剂(IMiD)、一种抗CD38单克隆抗体难治的复发难治多发性骨髓瘤(RRMM)患者。(2)用于治疗接受过至少2种系统疗法的复发或难治性DLBCL成人患者,包括滤泡性淋巴瘤(FL)引起的DLCBL。
值得一提的是,Xpovio是首个也是唯一一个获FDA批准的核输出抑制剂(SINE),该药也是自2015年以来首次针对骨髓瘤新靶点(XPO1)的批准药物。此外,Xpovio也是目前被批准用于治疗复发或难治性DLBCL的唯一一种单药口服疗法。
目前,Xpovio二线治疗多发性骨髓瘤的补充新药申请(sNDA)正在接受美国FDA的审查。如果获批,Xpovio将为复发或难治性MM患者的治疗模式提供一个重要的补充。当前,Karyopharm正在多个中后期临床研究中评估selinexor治疗一系列血液系统恶性肿瘤和实体瘤的潜力,包括多发性骨髓瘤(MM)、弥漫性大B细胞淋巴瘤(DLBCL)、脂肪肉瘤(SEAL研究)、子宫内膜癌、复发性胶质母细胞瘤。(生物谷Bioon.com)

