基于特异性转录调控因子LhgR的L-2-羟基戊二酸生物传感器
注:文末有研究团队简介及本文科研思路分析
L-2-羟基戊二酸(L-2-Hydroxyglutarate,L-2-HG)参与碳饥饿响应、肿瘤发生及缺氧适应等多个生理过程,但生物体感应并调控L-2-HG代谢的机制未见报道。另外,L-2-HG是L-2-HG尿症及多种癌症的标志性代谢物,在生物体正常生理代谢中也扮演重要角色,建立L-2-HG的高效、专一性检测方法具有重要的临床与研究意义。目前,L-2-HG的检测主要依赖于LC-MS/MS与GC-MS/MS等昂贵、繁琐的技术手段,难以实现手性异构体D-2-HG与L-2-HG的有效分离及活细胞内L-2-HG的动态检测。
针对以上难题,山东大学微生物技术国家重点实验室与上海交通大学、山东大学第二附属医院合作揭示了恶臭假单胞菌W619中L-2-HG分解代谢的调控机制,鉴定了可专一性感应L-2-HG的转录调控因子LhgR,并将其与荧光共振能量转移技术(FRET)相结合,构建了一种高性能的L-2-HG生物传感器,并应用于不同生物学样品、细菌及人类细胞中L-2-HG的检测。研究成果近日发表于Nature Communications,山东大学博士生康照琪为论文第一作者,山东大学高超教授与上海交通大学许平教授为该论文的共同通讯作者。
在本工作中,研究者基于比较基因组学分析发现,在恶臭假单胞菌W619中L-2-HG分解代谢关键酶LhgO上游编码GntR家族转录调控因子LhgR。生物学功能分析表明LhgR可结合至lhgO的启动子区域并抑制lhgO的转录,L-2-HG为LhgR的特异性效应物可抑制LhgR与lhgO启动子的结合。研究者将青色荧光蛋白mTFP与黄色荧光蛋白Venus分别融合至LhgR的N末端与C末端,开发了L-2-HG生物传感器LHGFR0N0C(图1)。LHGFR0N0C以剂量依赖方式响应于L-2-HG的添加,研究者进一步通过截短LhgR与荧光蛋白间linker对传感器进行优化。其中,传感器变体LHGFR0N7C动态范围60.37 ± 1.30%,Kd值为7.22 ± 0.38 μM;传感器变体LHGFR0N3C动态范围56.13 ± 0.29%,Kd值为29.33 ± 1.24 μM。两个传感器变体在检测特异性、动力学、温度稳定性、可逆性及pH稳定性等方面均表现出优异的性能。
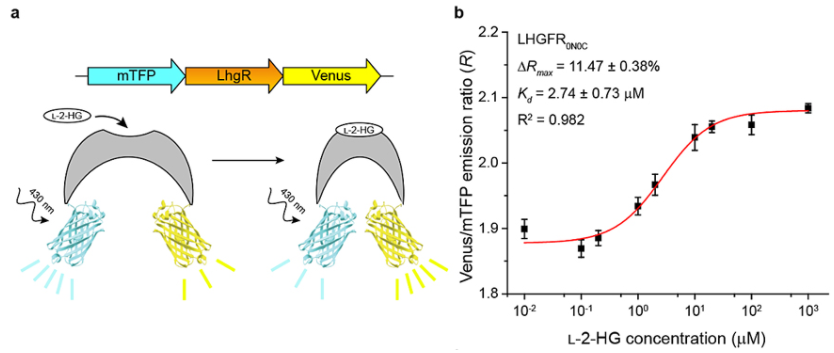
图1. LHGFR的设计与表征
L-2-HG传感器可应用于人体血清、尿液及细菌培养基中L-2-HG检测,结果与当前L-2-HG标准检测方法LC-MS/MS具有非常高的一致性(图2)。研究者进一步将开发的生物传感器应用于细菌胞内L-2-HG检测,在大肠杆菌中表达的LHGFR0N3C以剂量-依赖方式响应于外源L-2-HG添加,并可实时动态检测碳饥饿诱导的大肠杆菌胞内L-2-HG波动。此外,研究者还实现了L-2-HG传感器对人类细胞中L-2-HG的实时动态检测(图2),利用该生物传感器鉴定了L-2-HG脱氢酶在L-2-HG分解中的作用,确定缺氧可诱导L-2-HG的胞内积累。该工作提供了不同生物学样品、细菌及细胞中L-2-HG检测的灵敏简易方法,有助于L-2-HG代谢及相关疾病诊疗研究的开展。
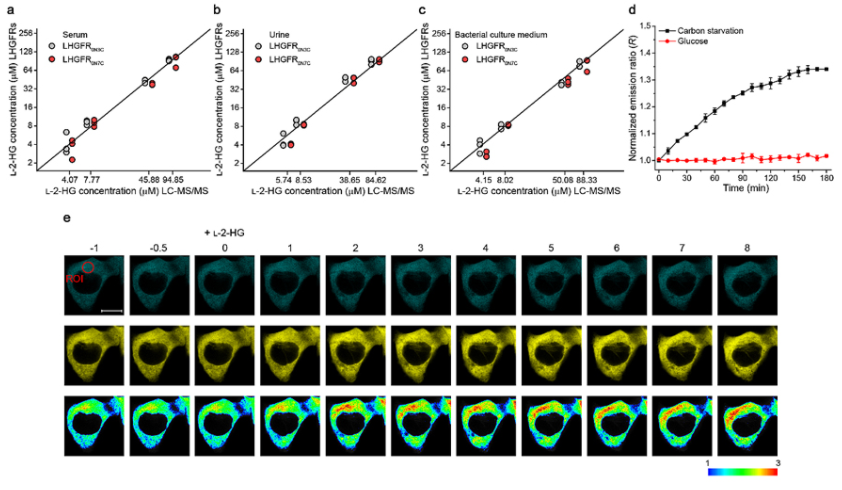
图2. LHGFR在不同生物学样品、细菌及细胞内L-2-HG检测中的应用
来源:X-MOL

