双金属MOF负载DNA酶用于体内药物合成及基因治疗
化疗是目前临床上应用最广泛的肿瘤治疗方法之一,但是经典的化疗药物往往存在严重的毒副作用,并且化疗会诱导肿瘤耐药并引起继发性的转移,为此,如何有效降低化疗对正常组织的伤害,并抑制肿瘤的复发和转移,成为了治疗的关键问题。
针对上述问题,中国科学院长春应用化学研究所的曲晓刚教授团队提出了一种负载DNA酶的双金属MOF联合治疗策略,用于共触发的体内药物原位合成和DNA酶介导的基因治疗。该MOF被肿瘤细胞摄取后,响应溶酶体的酸性环境解体并释放铜离子、锌离子和DNA酶。一方面,铜离子被还原成一价铜离子,在细胞内原位催化抗癌药物白藜芦醇类似物的合成;另一方面,锌离子作为金属辅因子激活DNA酶的切割活性。该抗肿瘤药物是在细胞内原位合成的,可以就地杀死肿瘤细胞,从而将对正常组织的毒副作用降到最低。同时,激活的DNA酶通过靶向切割与转移密切相关的EGR-1 mRNA,抑制肿瘤的增殖和转移。
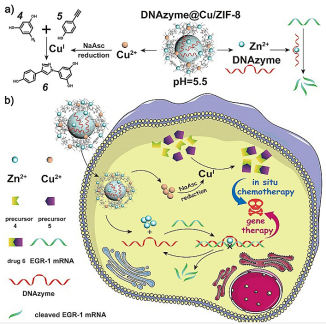
该纳米粒子在细胞内展现了优异的催化活性,有效地将无毒的前体分子转化为抗肿瘤药物,原位杀伤肿瘤细胞。并且经纳米粒子处理后,细胞的EGR-1表达水平明显降低,进一步研究发现EGR-1表达降低的肿瘤细胞,其侵袭转移能力也被严重削弱。作者进一步考察了所建立的联合治疗策略在裸鼠肿瘤模型中的抗肿瘤和抗转移效果。在治疗21天后,裸鼠的肿瘤大小明显减小,体重几乎没有发生变化,该纳米粒子展现出良好的抗肿瘤效果和生物相容性。并且,与对照组明显的肺转移相比,实验组显著地遏制了转移。
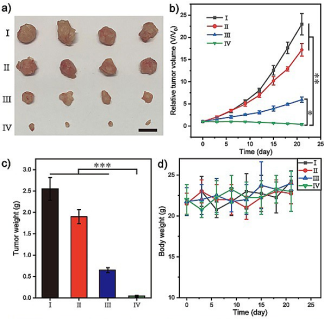
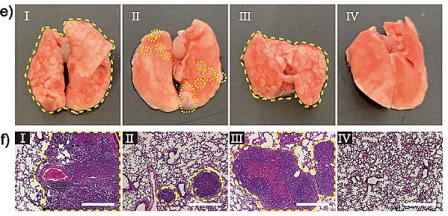
上述结果表明,所提出的联合治疗策略不仅可实现体内合成抗肿瘤药物,避免了传统化疗的副作用,而且DNA酶介导的自给基因治疗可抑制肿瘤的转移,为改善治疗效果提供了新思路。
这一成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是长春应用化学研究所博士研究生汪钊和牛京生。
来源:X-MOL

