溶液电导率变化实验结果与分析
1.实验用品
实验仪器:电导率传感器、pH 传感器、滴数传感器、磁力搅拌器、数据采集器、电脑及配套软件、磁子、容量瓶(200mL)、烧杯(50mL)、量筒、吸量管
实验药品:氢氧化钠(AR)、邻苯二甲酸氢钾(AR)、酚酞试剂
2.实验装置
按照图2所示搭建实验装置。

图2 实验装置示意图
3.实验过程
(1)配制 0.0250mol/L KHA 溶液及 0.1000mol/L NaOH溶液;
(2)向滴管中加入0.1000mol/L 的NaOH 溶液,排尽下端空气,打开开关阀,调节流速阀,使液滴以合适的速度成滴落下。按图2所示连接装置。调节滴管位置,保证液滴能被滴数传感器感应,并对滴数传感器进行校准;
(3)用移液管量取20.00mL 0.0250mol/L 的KHA溶液移至磁力搅拌器上装有磁子的烧杯(50mL)中,滴加2-3 滴酚酞试剂。插入电导率传感器,注意:避免磁子碰到电导率传感器金属探头;
(4)点击数据采集按钮,打开滴管下端的开关阀,观察实验现象变化和曲线变化。待数据曲线变化趋于稳定,关闭滴管的开关阀,并停止数据采集。重复实验三次。
(5)测定滴定pH值变化实验步骤同上,注意避免磁子碰到pH传感器玻璃探头。
四、实验结果与分析
1.电导率变化实验结果与数据记录
如图3 所示,通过三组平行实验得出三条NaOH溶液滴定KHA溶液电导率变化曲线。
由实验原始数据记录,得出起始及结束时溶液的电导率,并结合软件自带的检查、正切分析功能确定滴定终点时三组实验溶液的电导率及消耗NaOH溶液体积,综合结果如表2所示。
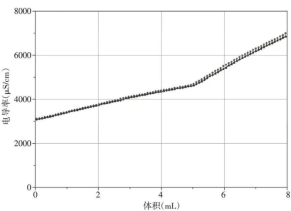
图3 电导率变化曲线
表2 KHA溶液与NaOH溶液反应过程中电导率相关数据记录
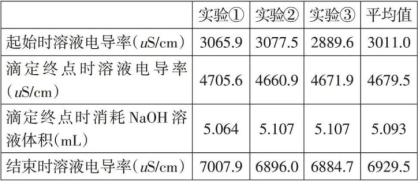
起始时,暂未滴加NaOH溶液,此时溶液电导率数值最小,其平均数值为3011.0μS/cm,溶液显无色。开始滴定后,溶液电导率立即增大,电导率曲线逐渐上升。当NaOH 溶液滴定体积在接近5mL 时,溶液中开始出现局部红色,继续滴定,溶液完全变为红色,电导率曲线出现转折,上升幅度增加。最终随着NaOH 溶液的继续加入,溶液电导率继续增加至滴定结束。
2.pH变化实验结果与数据记录
如图4 所示,通过三组平行实验得出三条NaOH溶液滴定KHA溶液pH值变化曲线。
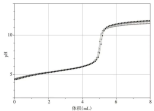
图4 pH变化曲线
通过软件自带的一阶导数图功能对三条曲线进行分析得出曲线如图5所示,通过检查功能分析及实验数据得出三条曲线滴定终点时NaOH溶液消耗体积及溶液pH如表3所示。
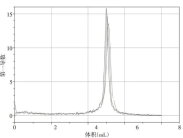
图5 pH变化一阶导数曲线
表3 KHA溶液与NaOH溶液反应过程中pH相关数据记录
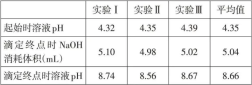
由图5 和表3 可以得出,起始时,溶液pH 平均值为4.35,溶液显无色,说明邻苯二甲酸氢钾(KHA)溶液显酸性。开始滴定后,溶液pH 值增大。当NaOH溶液滴定体积在接近5mL时,溶液中开始出现局部红色,继续滴定溶液完全变为红色,pH 曲线发生突跃,随着NaOH 溶液的继续加入,pH 值继续增大直至趋于稳定。
3.“四重表征”分析
邻苯二甲酸氢钾(KHA),分子式为C8H5KO4。常温下为无色单斜结晶或白色结晶性粉末。在空气中稳定,能溶于水,微溶于醇。
实验使用0.1000mol/L NaOH 溶液滴定20mL 0.0250mol/L KHA 溶液,理论计算可知溶液恰好完全反应时NaOH 体积应为5.00mL。通过软件自带的检查、正切、一阶导数分析功能,确定电导率实验滴定终点消耗NaOH 溶液体积5.093mL处,pH实验滴定终点消耗NaOH 体积为5.04mL 处,在误差允许内,两实验得到的滴定终点是一致的。
溶液之所以能够导电是由于溶液中自由离子的定向移动,电导率传感器通过电极之间的电流来测量溶液的导电能力。在溶液中,电流通过离子来传输。因此,溶液离子浓度越高其导电能力就越强,由于离子所带电荷数目不同,不同种类的离子导电能力不同。
选择一组电导率实验数据与pH 实验数据,利用Origin软件作图,结果如图6所示。对其进行“四重表征”分析,如表4所示。
通过“四重表征”分析,针对学生概念性错误、宏微结合能力不足、知识迁移困难等问题,以实验事实与理论解析的方式,帮助学生克服认知障碍。
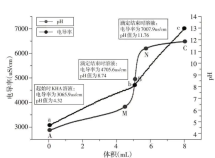
图6 电导率实验与pH实验Ⅰ综合曲线图
表4 “四重表征”分析


来源:百度搜索

