调控过渡金属掺杂空心铈级联纳米酶的多酶活性,实现增强的化学动力学治疗
纳米酶驱动的化学动力学疗法(NCDT)的临床应用受到其受限的催化效率,内源性H2O2含量不足及其脱靶消耗等因素的严重限制。为了解决这个问题,哈尔滨工程大学杨飘萍(点击查看介绍)团队与新加坡南洋理工大学赵彦利教授(点击查看介绍)合作引入一种“拓宽源头,减少H2O2的脱靶支出”策略,打破了肿瘤微环境里H2O2的自稳态,避免了外源引入H2O2或H2O2前药引起的生物安全性问题。通过掺杂价态可变的Mn2+可以引起氧化铈结构的重建,加速Ce4+向Ce3+的转换及氧空穴的产生,再基于氧化铈不同酶活性的pH依赖性,实现了肿瘤微酸环境下增强的POD-like、SOD-like酶活性,以及抑制的CAT-like酶活性,实现了特异性的H2O2富累积,减少了H2O2的脱靶消耗,以此实现了增强的化学动力学治疗。
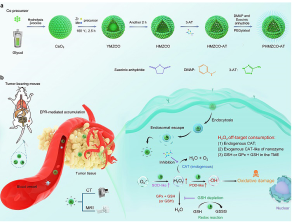
本文要点:(1)基于柯肯达尔效应,通过溶剂热法合成了单分散的从蛋壳结构到中空介孔结构的Mn,Zr共掺杂的氧化铈基纳米酶,进而负载内源性过氧化氢酶抑制剂3-3-amino-1,2,4-triazole (3-AT),并对其形貌、晶体结构和化学组成进行了详细地表征。
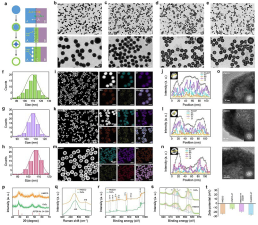
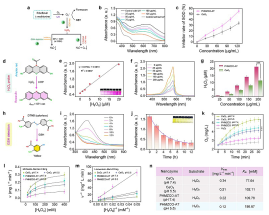
(2)通过对PHMZCO-AT多酶活性的调控,在TME下过氧化氢的脱靶消耗得到了很好的抑制,其中过氧化氢的脱靶消耗主要包括:内源性过氧化氢酶;外源性PHMZCO-AT的类过氧化氢酶以及内源的GSH或者GSH + GPx。通过体外实验验证了PHMZCO-AT增强的SOD-like和POD-like酶活性以及抑制的CAT-like酶活性,并通过DFT计算证明了Mn,Zr掺杂对其酶活性的影响。
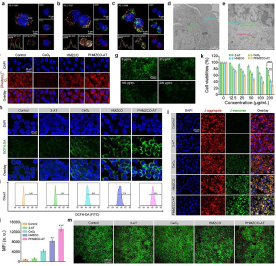
(3)体外和体内抗肿瘤实验评估均证实,PHMZCO-AT级联纳米酶实现了较好的肿瘤抑制效果。总体而言,通过这项工作对如何利用内源性微环境实现纳米酶的多酶活性的调控以实现有效的肿瘤治疗提供了有希望的策略。
这一成果近期发表在Advanced Materials 上,文章的第一作者是哈尔滨工程大学博士研究生董书明和董禹杉。X-MOL

