肿瘤微环境中的 T 细胞调节用于癌症免疫治疗
近日,Nature Communications 在线发表了一篇来自俄亥俄州立大学药学院董一洲(点击查看介绍)课题组的研究工作,报道了新的磷脂衍生物用于mRNA递送从而和相应的抗体一起调节肿瘤微环境中的 T 细胞并用于癌症免疫治疗。
T 细胞调节在多个治疗方向上彻底改变了免疫疗法。例如,免疫检查点抑制剂的使用通过靶向 T 细胞共抑制通路(如 PD-1 和 CTLA-41)提高了癌症患者的总体生存率。嵌合抗原受体 (CAR) T 细胞疗法已被批准用于治疗某些类型的急性淋巴细胞白血病和 B 细胞淋巴瘤。尽管有这些突破性的疗法,但将治疗相关的调节剂(例如 mRNA)有效递送至 T 细胞仍然是一项艰巨的挑战。
为了解决这种对 T 细胞的传递障碍,作者对各种生物材料进行了大量的分析。经过仔细考虑,细胞膜的天然成分磷脂和糖脂成为潜在的候选物。这些化合物具有几个物理化学特征:良好的生物相容性、高度的化学多样性和独特的膜相互作用。受这些特性的启发,他们合成并配制了一组磷脂衍生物和一组糖脂衍生物。在 T 细胞模型中进行的许多试点研究和配方筛选最终将 PL1 鉴定为铅磷脂衍生物。之后,作者检查了 B16F10 小鼠黑色素瘤肿瘤模型中的 mRNA 传递。重要的是,与游离 mRNA 相比,PL1 配制的脂质纳米粒子 (PL1 LNP) 可以显着提高肿瘤微环境中的递送效率。
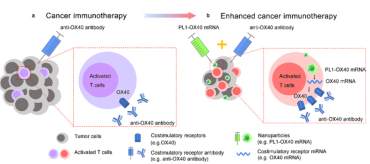
图1. 用于癌症治疗的增强免疫疗法示意图。(a) 通过激动剂抗体进行的免疫治疗。(b) 通过纳米颗粒与激动抗体的组合增强免疫治疗。
接下来的问题是如何用 PL1 LNP 调节 T 细胞以用于治疗应用?在过去的几十年里,研究人员在 T 细胞上发现了一系列用于癌症免疫治疗的共刺激受体。这些共刺激受体与其相应的配体相互作用,从而激活克隆性 T 细胞的扩增和分化。例如,OX40(也称为 CD134)是一种 T 细胞共刺激受体,为 CD8 T 细胞提供激活信号。尽管共刺激信号对刺激 T 细胞至关重要,但在肿瘤微环境中的表达水平较低,这可能是 OX40 不可知抗体介导的免疫疗法临床试验中反应率低的原因。因此,作者假设将共刺激受体 mRNA 局部递送至肿瘤浸润性 T 细胞将增强不可知抗体的抗肿瘤作用并最大限度地减少全身副作用(图1)。随后,作者在多个小鼠肿瘤模型中进行了实验。结果表明,与单独的抗OX40抗体相比,PL1-OX40 mRNA和抗OX40抗体的组合表现出显着提高的抗肿瘤活性。此外,当与免疫检查点抑制剂联合使用时,可以进一步增强治疗效果。最后,作者探索了治疗方案的全身给药,该方案在肺转移小鼠模型中显示出强大的抗肿瘤活性。总体而言,这些概念验证研究探讨了 T 细胞和免疫治疗方案中 mRNA 递送的挑战,这有助于未来对 T 细胞调节的深入探索。来自多个学科的许多团队成员和合作者为这项工作做出了重大贡献。
来源:X-MOL

