复杂天然产物Phainanoid A的首次全合成
达玛烷类三萜(Dammarane-type triterpenoids)作为一类从植物中提取的具有广泛生物活性的复杂天然产物,长期以来因其潜在的高成药价值而备受关注。近年来,更多结构复杂,活性新颖的达玛烷类三萜天然产物也逐渐被发现,例如中科院上海药物研究所岳建民院士团队就从一种来源于海南岛的植物——海南叶下珠(Phyllanthus hainanensis)——中分离得到了一类复杂的具有高度免疫抑制活性和细胞毒性的达玛烷类三萜天然产物Phainanoids,其复杂的结构和良好的生物活性引起了合成化学界的广泛关注。近日,芝加哥大学化学系的董广彬教授(点击查看介绍)课题组通过设计一种独特的基于酮羰基战略利用的双向合成策略,率先实现了对Phainanoid A的高效全合成。这一成果近期发表在J. Am. Chem. Soc.上。
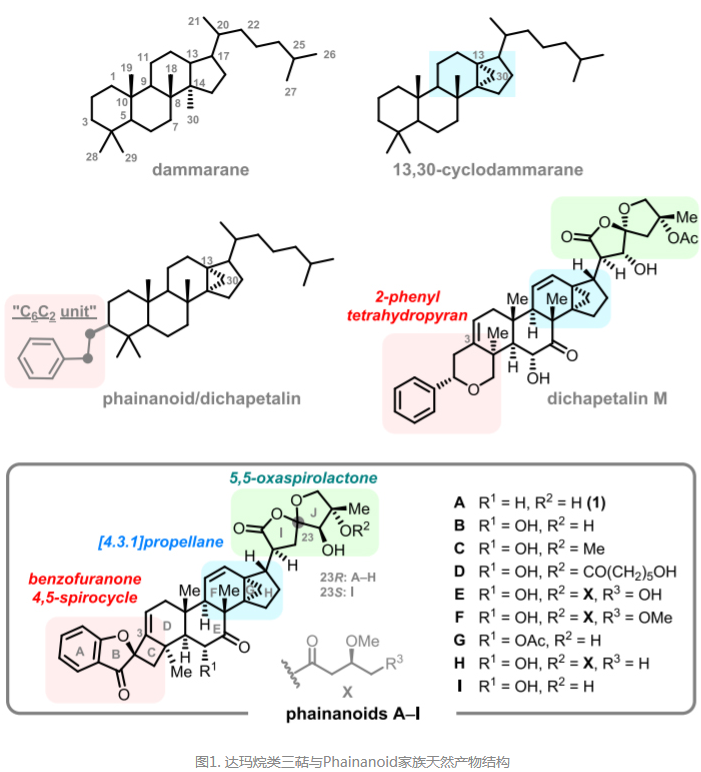
分子结构上,Phainanoids属于一类C3位点连接一个“C6C2”单元的13,30-环达玛烷类三萜,复杂的十环体系(含三、四、五和六元环)中分布着多达13-15个手性中心(含C8-C14-C13连续全碳季碳中心在内的8个四取代手性碳中心),它们不仅拥有极具合成难度的[4.3.1]螺桨烷核心骨架结构和高度氧化的螺环内酯型侧链,其“C6C2”单元还形成了一个首次在天然产物中发现的基于3-苯丙呋喃酮的独特4,5-螺环结构。虽然初步的构效关系研究认定其优良的生物活性或与这些螺环结构相关,但其免疫抑制活性的作用机制尚不明确。由于天然来源稀缺,这些活性天然产物后续的药化和生物研究面临极大挑战,开辟一条高效简洁的化学合成途径对其后续研究具有重大意义。
由于Phainanoid家族天然产物独特的结构特点,高效的逆合成策略对于有效提高分子合成效率显得尤为重要。结构上,该家族分子具备潜在高反应活性的高张力螺环丁烷结构、烯基环丙烷结构和5,5-螺环内酯结构。由于它们分布在DEF三环骨架的左右两侧,作者认为一个较理想的方案是先采用多烯环化反应策略立体选择性地构建较简单的DEF三环体系,然后在三环核心骨架的基础上通过双向合成的策略在后期逐步引入上述较为敏感的环系结构以降低合成后期的操作难度。按照逆合成分析的思路进一步展开,分子右侧[4.3.1]螺桨烷中的五元(H)环可以通过还原Heck反应予以构建,随后通过一步仿生的高烯丙位环化消除反应获得烯基环丙烷(G环)和C11–12烯烃结构;5,5-螺环内酯侧链则可以在酸催化的螺缩酮化后通过Horner-Wadsworth-Emmons(HWE)反应得以引入。分子左侧的4,5-螺环结构构建得益于作者早先发表的的钯催化分子内酮α烯基化反应方法学,其中3-苯并呋喃酮结构则可以通过形式羟醛缩合反应予以引入。值得一提的是,C7位羰基的引入也是一个不容忽视的难点。作者认为此处的氧官能团可以巧妙利用由Schönecker教授所发展的环戊酮羰基导向选择性C–H氧化反应引入,再通过进一步官能团转化和基于多烯环化策略的切断,DEF三环体系最终得以简化为多烯前体化合物11。
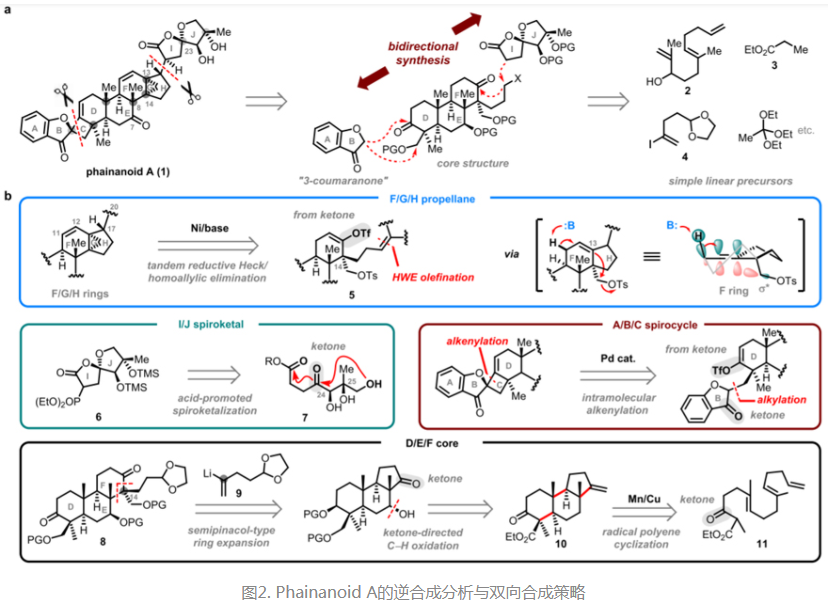
由此,作者通过巧妙设计双向合成的途径,从已知化合物2出发,最终以最长线性步骤29步实现了对该家族天然产物的首次全合成。这一策略的成功依赖于作者对酮羰基的战略应用以实现全部关键反应的转化,其中包括自由基多烯环化反应构建DEF三环骨架,羰基导向的C–H氧化反应引入C7氧官能团,基于环戊酮的半频哪醇重排扩环反应,酸催化的螺缩酮化反应构建5,5-螺环内酯结构,以及最关键的过渡金属/烯醇三氟甲磺酸酯(酮转化而来)介导的两侧张力环系的非对映选择性构建。因此,该工作中所展现的立体选择性高效化学转化与合成策略对达玛烷类三萜天然产物的后续合成研究将具有重要的意义。
来源:X-MOL

