缓冲溶液的缓冲原理怎么解释
发布日期:2021/11/16 11:31:00
缓冲原理:假设缓冲溶液里含有弱酸HA以及它的共轭碱 。在溶液里发生的质子反应为:
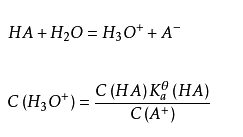
水合氢离子的浓度取决于弱酸与其共轭碱的浓度比。当加入少量强碱时,酸被中和,导致了氢氧根离子在溶液中很少累积,从而 的浓度增加, 的浓度减少。可以看到,虽然加入了强碱,但是溶液里的氢氧根离子变化很少。
同时,浓度较大,相对的变化小,两者比值几乎无变化,因此根据公式,水合氢离子的浓度变化很小。加入弱酸则是同样的道理。由于在大浓度基数上的微小变化不会改变比值,也因此维持了体系内氢离子和氢氧根离子浓度的平衡。

扩展资料:
1、缓冲液的pH值与该酸的电离平衡常数Ka及盐和酸的浓度有关。弱酸的pKa值衡定,但酸和盐的比例不同时,就会得到不同的pH值。酸和盐浓度相等时,溶液的pH值与PKa值相同。
2、酸和盐浓度等比例增减时,溶液的pH值不变。
3、酸和盐浓度相等时,缓冲液的缓冲效率为最高,比例相差越大,缓冲效率越低,缓冲液的一般有效缓冲范围为pH=pKa±1,pOH=pKb±1。
参考资料:百度百科-缓冲溶液

