Nat. Commun.:模拟过氧化物酶体的纳米杂化凝胶用于肿瘤化学动力学和光动力学治疗
近日,《自然•通讯》(Nature Communications)杂志在线报道了华东理工大学材料科学与工程学院李永生教授、牛德超教授研究团队和同济大学化学科学与工程学院王启刚教授、王霞副教授研究团队在“模拟过氧化物酶体的纳米杂化凝胶用于肿瘤化学动力/光动力学治疗”上取得的研究进展。
近年来,肿瘤细胞内活性氧物种(ROS)的控制在肿瘤治疗过程中起着至关重要的作用。过氧化物酶体(Perxisome)是一种含有多种氧化酶/抗氧化酶体系的特殊杂化细胞器结构,主要包括产生过氧化氢(H2O2)的氧化酶和代谢有毒物/H2O2的过氧化氢酶。受过氧化物酶体中H2O2的活化和氧气代谢途径启发,本研究工作通过将乳酸氧化酶(LOx)和过氧化氢酶(CAT)引入到担载有Fe3O4纳米颗粒和吲哚菁绿(ICG)的有机-无机杂化纳米凝胶中,以此来研究ROS诱导的肿瘤化学动力学/光动力学治疗(图1a)。其中,芬顿试剂Fe3O4纳米颗粒通过亲疏水作用包覆在两亲性嵌段共聚物形成的胶束内核中,利用有机硅烷对胶束结构进行稳定并其同时引入光敏剂ICG,进一步通过表面的磷酸酶触发的寡肽自组装形成双酶(LOx和CAT)共担载的有机-无机纳米杂化凝胶体系。通过LOx和CAT的级联催化作用,微环境中O2被高效利用,并级联活化H2O2显著提高细胞内ROS的水平。更有意义的是,通过控制LOx和CAT的比例,可以精准调节羟自由基(•OH)和单线态氧(1O2)的产生(图1b)。基于此,该有机-无机杂化纳米凝胶在活体层面展示出了高效的谷胱甘肽激活的化学动力学治疗和近红外光触发的光动力学治疗效果(图2)。这种具有活性氧调节能力的有机-无机杂化纳米凝胶,有望在治疗表现为不同氧化还原状态、大小和皮下深度的恶性肿瘤或其他重大疾病方面展示出巨大的应用潜力。
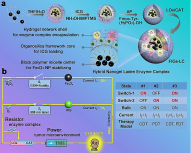
图1. 双酶担载纳米杂化凝胶的合成示意图及其治疗机理图
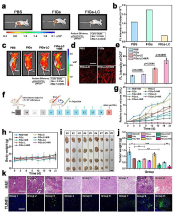
图2. 双酶担载纳米杂化凝胶在活体层面的治疗效果
来源:X-MOL

