催化剂控制的对映异构溴化反应
制备对映体化合物在药品和天然产品的合成中是至关重要的,而不对称催化则是其最流行的实现方法之一。为了进行更加全面的生物学研究,我们往往希望同时得到化合物两种拥有生物活性的对映异构体。然而,手性催化剂的对映体有可能难以获得,因此以高光学纯度合成全部两种对映体产物并非易事。金鸡纳碱所衍生的催化剂就是一个典型示例——金鸡纳碱的非天然对映体并不容易获得,而且它们的假性对映体变体在许多情况下催化性能不一致。对于这种情况,对映异构催化不失为一个很有吸引力的解决方案——通过利用结构中具有相同立体元素的催化剂,我们可以获得手性产物的两种异构体。除此以外,在保持立体成分和官能团不变的同时改变远离手性环境的非手性取代基,也可以实现催化剂控制的对映体转换。尽管目前鲜有报道,这同样是一种很有吸引力的方法。
利用异构催化剂来高效获取两种对映异构体的实例仍未曾实现,这一方向的研究可以为催化剂设计提供一种新的途径。最近,香港中文大学的谢应龙(Tse Ying-Lung)和杨英洋(Yeung Ying-Yeung)教授课题组报告了使用一对源于奎宁的异构催化剂,进行催化剂控制的对映异构溴化反应的首个案例(图1)。
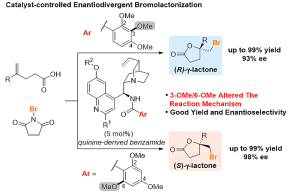
图1. 催化剂控制的对映异构溴化反应
他们的研究使用由奎宁衍生的苯甲酰胺作为手性催化剂,当改变苯甲酰胺上的非手性甲氧基取代基时,对映选择性会发生转换。这一现象适用于广泛的底物种类,并在合成上很有价值。作者也进行了机理研究以阐明这一催化剂中对映体分化和立体诱导的源头。手性内酯是药物化学和天然产物合成的有用构件,而不对称卤化是获得手性内酯的重要方法。此外,内酯产物中的卤素可以容易地被操纵,以获得各种有用的衍生物。
他们发现,含有苯甲酰胺非手性取代基的9-epi-氨基喹啉衍生催化剂A0可以使用N-溴代琥珀酰亚胺(NBS)催化1a到(R)-2a的不对称溴代内酯化,并具有良好的对映选择性(27% e.e.)(图2)。进一步研究发现,2,3,4-三甲氧基苯基催化剂A2对于(R)-2a的选择性可以达到82% e.e.,而2,4,6-三甲氧基苯基催化剂B2可以催化合成反式的(S)-2a,并达到82% e.e.的选择性。这一现象很不寻常。因为A2与B2作为异构体的唯一的区别,仅仅是甲氧基取代基(C3或C6)的位置与金鸡纳碱手性骨架的距离不同,但它们的不对称诱导行为则明显不同。进一步优化表明催化剂A5与B5具有更好的催化性能以获得高手性的(R)-2a (91% ee) 与(S)-2a (98% ee)。催化方法适用于广泛的底物。
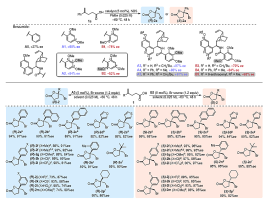
图2. 催化剂结构研究与底物扩展
基于实验与理论计算进行的机理研究表明,取代基的立体效应和电子效应的差异改变了反应机理。这一研究发现表明,手性催化剂上的非手性取代基不仅可以起到立体屏蔽的作用,还可以转换反应机理。
这一成果近期发表在JACS 上,文章的第一作者是香港中文大学博士研究生Yuk Cheung Chan和Xinyan Wang。
来源:X-MOL

