噬菌体运用Anti-CRISPR蛋白防御CRISPR-SpyCas9系统的分子机制
2018年12月31日,《分子细胞》(Molecular Cell)杂志在线发表了中国科学院生物物理研究所王艳丽课题组在CRISPR-Cas系统研究中取得的最新进展。该研究工作成功解析了Anti-CRISPR蛋白AcrIIA2与Streptococcus pyogenes Cas9(SpyCas9)蛋白及single-guide RNA(sgRNA)的三元复合物3.3埃的晶体结构,并结合体内和体外的功能实验,系统地阐述了噬菌体运用Anti-CRISPR蛋白防御CRISPR-SpyCas9系统的分子机制。
王艳丽课题组一直致力于CRISPR-Cas系统抗病毒作用机理的研究,前期研究揭示了一系列重要的CRISPR-Cas系统的作用机理(Nature 2014,Cell 2015,Cell Res.2016,Cell 2017a,Cell 2017b,Mol.Cell 2017,Cell 2018);该工作是王艳丽课题组首次在Anti-CRISPR蛋白防御CRISPR-Cas系统作用机理的研究中取得突破。
CRISPR/Cas系统是古菌和细菌抵抗病毒和质粒侵染的重要免疫防御系统。CRISPR-Cas系统划分为两大类,第一大类CRISPR-Cas系统由多亚基组成的效应复合物发挥功能;第二大类是由单个效应蛋白(如Cas9,Cas12a,Cas12b,Cas13等)来发挥功能。其中,Cas9,Cas12a,Cas12b均具有RNA介导的DNA核酸内切酶活性,Cas13a具有RNA介导的RNA核酸酶活性。面对细菌的免疫系统(CRISPR-Cas),噬菌体也相应进化出了自己的防御系统(Anti-CRISPR)。2017年首次发现了Listeria monocytogenes噬菌体来源的四个Anti-CRISPR蛋白,AcrIIA1,AcrIIA2,AcrIIA3和AcrIIA4。研究发现AcrIIA2和AcrIIA4蛋白在细胞内能够抑制SpyCas9的基因编辑活性。随后的结构和功能研究表明AcrIIA4通过阻断DNA与SpyCas9的结合来抑制SpyCas9的功能,然而AcrIIA2抑制SpyCas9活性的分子机制一直未能阐述清楚。
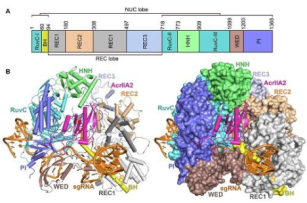
图注:AcrIIA2-SpyCas9-sgRNA三元复合物的晶体结构。(A)SpyCas9的结构域;(B)AcrIIA2-SpyCas9-sgRNA三元复合物的结构展示图。
在该研究中,研究人员首先通过生化实验发现AcrIIA2只与结合有sgRNA的SpyCas9二元复合物结合,并不与自由状态下的SpyCas9结合,也并不与同时结合有sgRNA和dsDNA的SpyCas9三元复合物结合。为了研究AcrIIA2直接抑制SpyCas9活性的分子机制,研究人员利用X-ray晶体学的方法成功解析了AcrIIA2-SpyCas9-sgRNA的三元复合物晶体结构(3.3埃)。结构发现AcrIIA2是由三个α螺旋及一个β折叠组成的紧凑结构,它结合在SpyCas9的一个带正电荷的凹槽区域。该区域由PI、HNH、WED和REC2结构域形成。PI结构域上R1333和R1335是识别dsDNA的PAM序列的关键氨基酸,AcrIIA2通过与R1333和R1335形成稳固的氢键从而阻断SpyCas9对PAM序列的识别,进而阻止SpyCas9对dsDNA的结合。而AcrIIA2的α1螺旋与HNH结构域的相互作用可以锚定HNH结构域,阻止其结合DNA必须发生的构象变化。另外,通过结构比对分析发现AcrIIA2有大量的带负电荷的氨基酸占据着dsDNA中PAM结合的位置,这表明AcrIIA2模拟带负电荷的DNA与SpyCas9结合从而阻止DNA与SpyCas9的结合。有趣的是,竞争性结合实验表明AcrIIA2并不能取代已经与SpyCas9-sgRNA结合的dsDNA,而dsDNA也不能取代已经与SpyCas9-sgRNA结合的AcrIIA2。总之,通过结构和功能实验的证明,AcrIIA2主要通过三个步骤来抑制dsDNA的结合。首先,AcrIIA2可以阻断PAM的识别;其次,AcrIIA2占据了dsDNA的结合位点;最后,AcrIIA2通过限制HNH结构域的构象变化来抑制dsDNA的结合。
目前,SpyCas9蛋白作为基因组编辑工具被广泛应用于DNA领域的基因编辑,克服了传统基因编辑技术步骤繁琐、耗时长、效率低等缺点,以其较少的成分、便捷的操作以及较高的效率满足了大多数领域的基因编辑需求,并有着潜在的临床应用价值。但是CRISPR-SpyCas9基因编辑系统也存在着一定的脱靶问题,该研究对Anti-CRISPR蛋白抑制SpyCas9活性分子机制的阐述为控制或终止SpyCas9活性提供了新的参考和思路。有望将Anti-CRISPR蛋白开发成新的基因编辑终止工具,实现精准基因编辑。
王艳丽为论文通讯作者。王艳丽课题组的刘亮为论文第一作者。该研究得到科技部、国家自然科学基金以及中科院战略性先导科技专项(B类)的资助,上海同步辐射光源(SSRF)以及日本同步辐射光源SPring-8为该研究提供了重要的技术支持。
文章来源: 生物物理研究所

