细胞外基质蛋白-1分泌性亚型通过增加mRNA的剪接和干性促进卵巢癌的进展
卵巢癌是全球女性妇科癌症死亡的第二大常见原因,在过去30年里,5年生存率只有20%。尽管在过去的20年里,卵巢癌的治疗和诊断取得了可喜的进展,但其诊断仍然主要是在晚期,治疗干预大多是姑息性的。因此,迫切需要深入探讨卵巢癌发生和发展的机制来寻找新的生物标志物和分子治疗靶点。近日,复旦大学附属肿瘤医院杨恭教授和上海中医药大学附属曙光医院生殖医学中心任春霞副主任医师团队联合发现细胞外基质蛋白-1分泌性亚型可通过增加mRNA的剪接和干性促进卵巢癌的进展,揭开了ECM1不同亚型调控卵巢癌进展分子机制的“神秘”面纱。相关结果近期已发表在Nature Communications 上,博士研究生俞殷珏、王婧姝博士、李慧博士和研究助理尹荟菁为共同第一作者。
目前的研究表明,ECM1在多个癌肿中扮演着促进肿瘤发生的角色,ECM1基因可以通过选择性的pre-mRNA剪接转录成4种成熟的mRNA,但不同编码亚型的单独功能却很少被报道。研究者首先通过对卵巢癌细胞系的体内外生物学实验及临床病人样本的检测发现,ECM1的a亚型为分泌型并诱导了肿瘤发生,而ECM1b为非分泌型蛋白,却对肿瘤的发生具有抑制作用。
团队通过RNA-seq及KEGG分析发现ECM1a及相关分子功能与类固醇生成、ECM受体相互作用、细胞粘附分子及ATP结合盒(ABC)转运体相关。进而通过co-IP及IF实验等发现,ECM1与整合素αXβ2的功能相互作用依赖于ECM1a而不是ECM1b,ECM1a通过GPR基序与整合素αXβ2结合,促进AKT/FAK/Paxillin/Rac的磷酸化从而诱导肿瘤生长。研究者将ECM1a中GPR基元突变至VAQ,发现ECM1a-WT除了与整合素αXβ2结合外,还能与整合素β1、JUP、Annexin A1、Calnexin和S100A9结合,而ECM1a-MT还能与其他细胞表面分子结合,如Plakophilin-1和S100A8。此外,ECM1a与αXβ2的结合可能差异调控FGA、FGG、ICAM1、PLG、iC3b、CD90和PF4的功能以及这些配体与整合素αXβ2的结合能力。而ECM1b不从细胞中分泌,也不与整合素αXβ2结合,非分泌性ECM1b直接与非磷酸化的myosin结合抑制其磷酸化,抑制了细胞骨架介导的信号转导从而发挥了抑制肿瘤发生和发展的作用。
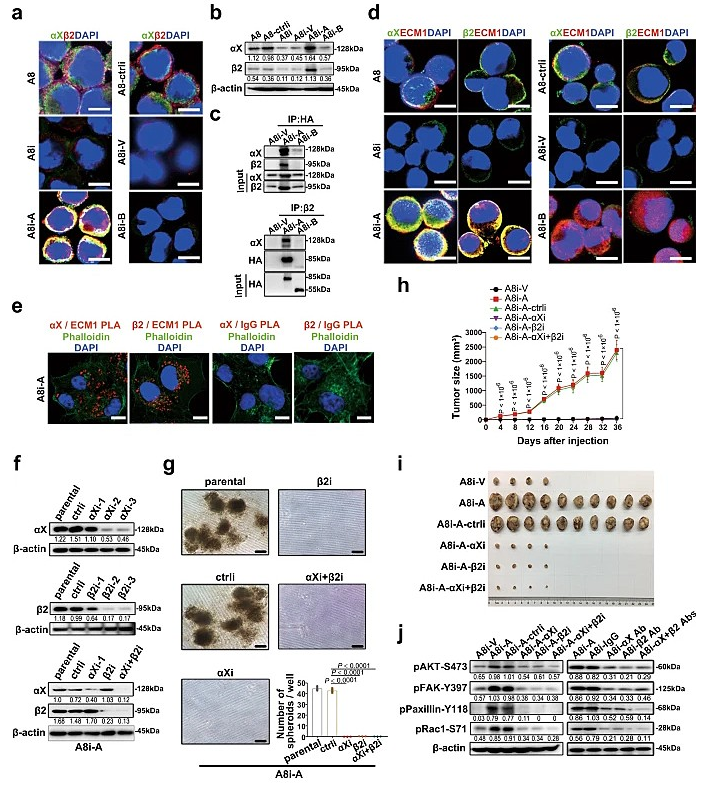
图1. ECM1a与整合素αXβ2的相互作用。图片来源:Nat. Commun.
对RNA-seq数据进一步分析,作者发现ECM1a对mRNA前体的剪接因子:异质核核糖核蛋白L样(hnRNPLL)蛋白表达具有很强的诱导作用,而ECM1b对hnRNPLL蛋白表达没有明显的诱导作用,通过对不同程度的敲低hnRNPLL表达发现ECM1每个亚型的mRNA水平都是高度稳定的,说明hnRNPLL选择性将mRNA剪接生成ECM1a而不是通过调控mRNA的稳定性来调控ECM1亚型的表达。
另一亮点分子为ATP结合盒亚家族G成员1(ABCG1),作者通过一系列实验证实了ABCG1促进AKT/FAK/Rho/细胞骨架分子的磷酸化,并通过上调细胞干性相关转录因子如c-myc和细胞干性标志物CD326促进细胞干性来给予卵巢癌细胞顺铂耐药的能力。而在研究ABCG1介导磷酸化的体外激酶实验中,作者惊讶地发现尽管没有证据表明ABCG1是一种激酶,但ABCG1确实使AKT2-WT在S474位点磷酸化(对应于AKT1 S473),而这种磷酸化被AKT丝氨酸磷酸化的特异性抑制剂MK-2206所抑制。另外,ECM1可以通过ABCG1调控肿瘤细胞对胆固醇的代谢。
研究的最后,作者通过IHC分析了临床病人标本中相关蛋白的表达,发现ECM1a、αXβ2、ABCG1和hnRNPLL的高表达预示卵巢癌患者的低生存,而ECM1b的高表达预示好的生存。这些结果强调ECM1a、整合素αXβ2、hnRNPLL和ABCG1是治疗与ECM1激活信号相关癌症的潜在靶点。该研究结论对卵巢癌以外的其他肿瘤治疗也许具有一定的参考意义。该研究团队目前正在致力于ECM1在其他肿瘤中的深入研究中,期盼更多的研究成功在不久的将来发表。
小结
综上所述,作者发现ECM1a通过整合素αXβ2/hnRNPLL/ ABCG1介导的细胞磷酸化信号转导和干性诱导发挥致瘤作用,并导致卵巢癌细胞顺铂耐药。ECM1a和ECM1b之间相反的致瘤作用。研究发现的ECM1a-整合素αXβ2相互作用诱导的细胞骨架磷酸化,hnRNPLL调控的ECM1a mRNA剪接,ABCG1介导的细胞骨架磷酸化和癌症干性都为卵巢癌的未来诊断与治疗提供了新思路与新靶点。
来源:X-MOL

